|
現在,世界各国でチップ技術の開発が進められており,既に複数のメーカから市販品が発売されている.これら市販品では,検体DNAを蛍光色素で標識し,DNAチップ上に吸着した検体DNAからの蛍光シグナルを観測する.しかし,この場合,蛍光色素の修飾量によって検出感度が大きく変化するために,定量性に問題がある.また,マイクロアレー上に残存する蛍光修飾された検体DNAによるS/N比の低下,蛍光分子の光退色による定量性の低下といった問題も存在する.更に,市販されているDNAチップ及び解析装置は非常に高価であり(例えばチップ単価:数万円以上,解析装置:数千万円),現在では研究機関への導入にとどまっている.
このようななか,安価かつ簡便で検出精度に優れ,定量的な解析を可能とする“次世代DNAチップ”の開発が行われている.例えば,縫い込み型インターカレータを用いた電気化学検出DNAチップでは,その高い検出感度及び選択性による定量性の向上が達成されている(2).しかし,基板上に電極を多数集積化することは困難であり,光リソグラフィーによる微細加工技術では,プローブDNAの集積度は限定されてしまう.これに対して,光を用いた分光学的検出手法は,空間分解能が高いために,集積度の高い(数千〜数万)チップを作製するためには有効である.また,チップ自体に特別な微細加工を必要としないために,安価なDNAチップをデザインすることが可能となる.筆者らは,分光的手法による新規DNA検出技術の開発に取り組んでいる.本稿では,筆者らが開発した新規検出技術の概要,特性,及びDNAチップへの応用性について紹介する.
■2. 検出原理
DNA鎖はアデニン(A),シトシン(C),グアニン(G),チミン(T)の四つの塩基が鎖状につながった高分子であり,通常,ワトソン−クリック型の塩基対(A-T,G-C)によって二重らせん構造を形成する(3)(図3).これまでの研究から,一本鎖DNA鎖は二重らせん構造である二本鎖DNAとなることで,その鎖長が変化することが明らかとなっている(4).筆者らはこの鎖長変化に着目した.
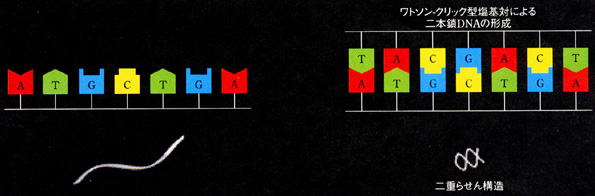 |
図3 二本鎖DNAの形成
DNA鎖はアデニン(A),シトニン(C),グアニン(G),チミン(T)の四つの塩基が鎖状につながった高分子である.ワトソンクリック型の塩基対により二重らせん構造である二本鎖DNAを形成し,通常,二本鎖の状態で生体中に存在する. |
図4に予想した検出原理の概略を示す.末端に金ナノ微粒子を修飾した一本鎖DNAを金薄膜基板上に固定化し,これをプローブDNAとした.プローブDNAが検体DNAとハイブリダイゼーションして二本鎖を形成すると,鎖長変化により固体基板表面と金ナノ微粒子の距離が変動する.金薄膜基板に光を照射し,その表面プラズモン共鳴(SPR:Surface
Plasmon Resonance)応答を観測すると,微粒子の位置変動によってSPR応答が変化する(5).このように,金ナノ微粒子修飾プローブDNAを金薄膜基板に固定化することにより,検体DNAとの二本鎖形成反応を検出することが可能となる.
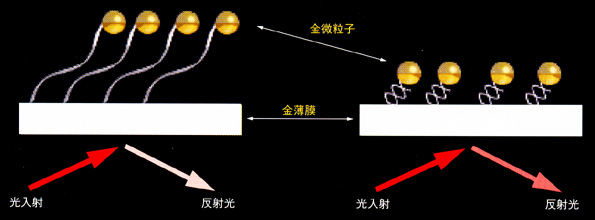 |
図4 鎖長変化を利用したDNA検出技術の概略
末端に金ナノ微粒子を修飾した一本鎖プローブDNAを金薄膜基板上に固定する.検体DNAとのハイブリダイゼーション反応により二本鎖となったプローブDNAはその鎖長が短くなるために,金微粒子は金薄膜表面に近づく.金薄膜に光を入射し,反射光をモニターすると,金微粒子の位置変動により反射光の強度,波長が変化する. |
|

